原子结构
从原子论到量子理论
原子论由来已久。但是从公元前五世纪古希腊哲学家提出原子论到文艺复兴时期波义尔、牛顿等科学家让原子论再次流行,原子论似乎始终停留在哲学和物理层面,对解释物质的化学性质没有实际意义。
到了19世纪初,拉瓦锡现代化学元素概念的确立和普鲁斯特化合物定比定律(同一种化合物中不同元素的重量比为定值)的发现为道尔顿原子论的提出奠定了基础。1803年道尔顿在他的笔记本中清晰的描述了他的原子理论:(1)化学元素是由不可分割的微小原子组成;(2)同一种元素的所有原子都相同,不同元素具有不同的原子,而不同原子的区别在于其不同的重量;(3)化合物中的不同元素的原子数量比为简单的整数比。道尔顿的原子论为解释普鲁斯特化合物定比定律提供了清晰的微观依据,并在化学家中得到了迅速的普及。随着分析化学的发展,各种原子的原子量和化合物的元素原子比例(也就是分子式)都被确定下来。
18世纪末电子的发现使不可分割的道尔顿原子不再成立。19世纪初各种关于原子内部结构的模型被提出。1913年波尔在卢瑟福原子核模型和普朗克量子理论的基础上,提出了革命性的量子原子模型。这个模型用简单的数学公式完美的解释了氢原子光谱。波尔原子模型是量子理论在20世纪初的一次伟大胜利,而之后不久出现的量子力学彻底改变了我们对微观原子世界的认识。目前人类对于原子结构的探索仍在继续。核物理学家正在研究原子核内部质子和中子的排布方式以及原子核的终极尺寸等问题。另外,我们现在知道质子和中子是由更小的基本粒子(夸克)组成。通过宏伟的粒子加速器和高能粒子碰撞实验,粒子物理学家正在寻找和研究组成物质和辐射(如光)的基本粒子和它们之间的作用力,试图解释物质起源这一终极的科学和哲学问题。
上图:德布罗意波。
第一行从左至右:氢(H),碳(C),氮(N),氧(O),磷(P),硫(S)。
第二行从左至右:铁(Fe),锌(Zn),铜(Cu),铅(Pb),银(Ag),铂(Pt),金(Au),汞(Hg)。
第三行从左至右:一氧化碳(CO),二氧化碳(CO2),一氧化氮(NO),一氧化二氮(N2O)。
注释:说有数字都应为下角标。
道尔顿原子论。早在公元前五世纪,希腊哲学家就提出了原子论思想。文艺复兴之后,波义耳和胡克等科学家也应用原子理论或微粒学说解释某些自然现象。但道尔顿在1803年提出的原子论与前人学说本质不同的两点是:(1)不同的元素具有不同的原子,(2)不同的原子具有不同的重量。19世纪初,道尔顿的原子论在化学家中得到了广泛的认可,从而在理论层面推动了现代化学的发展。另外在1808年出版的著作《化学哲学新体系》(New System of Chemical Philosophy)中,道尔顿为当时知道的每一种元素都设计了一个圆形的符号,并且用这些符号的组合来表示简单的化合物(上图)。但是由于当时的很难精确测定原子的质量,道尔顿当时给出的很多化合物的原子比例都是错误的(上图有意回避了比例错误的化合物)。【绘图依据:Dalton, J. New System of Chemical Philosophy (1808)】
左上:动子模型,右上:土星模型,左下:布丁模型,右下:原子核模型。
早期原子模型。道尔顿的原子是不可分割的最小单元。但从1897年汤姆孙发现电子开始,新的实验结果让科学家认识到原子也存在着复杂的内部结构。20世纪初期出现了一系列原子模型。上图包括了4个模型,其中红色表示带正电,蓝色表示带负电。动子模型:由莱纳德于1903年提出。莱纳德认为原子中存在微小的“动子”(Dynamid),每个动子包含一个正电荷和一个负电荷,所有动子被一个大部分为空的球形外壳包围。土星模型:由长冈半太郎于1904年提出。长冈半太郎认为原子与土星类似,由中心带正电的球体和围绕球体旋转的电子组成。布丁模型:由汤姆孙于1904年提出。汤姆孙认为原子由带正电的球形外壳和在其上运动的电子组成。原子核模型:由卢瑟福于1911年提出。卢瑟福认为原子由位于中心带正电的原子核和围绕原子核运动的电子组成,原子核体积极小但集中了原子的大部分质量。【绘图依据:Ihde, A. J. The Development of Modern Chemistry (1964)】
中心黑点为原子核。
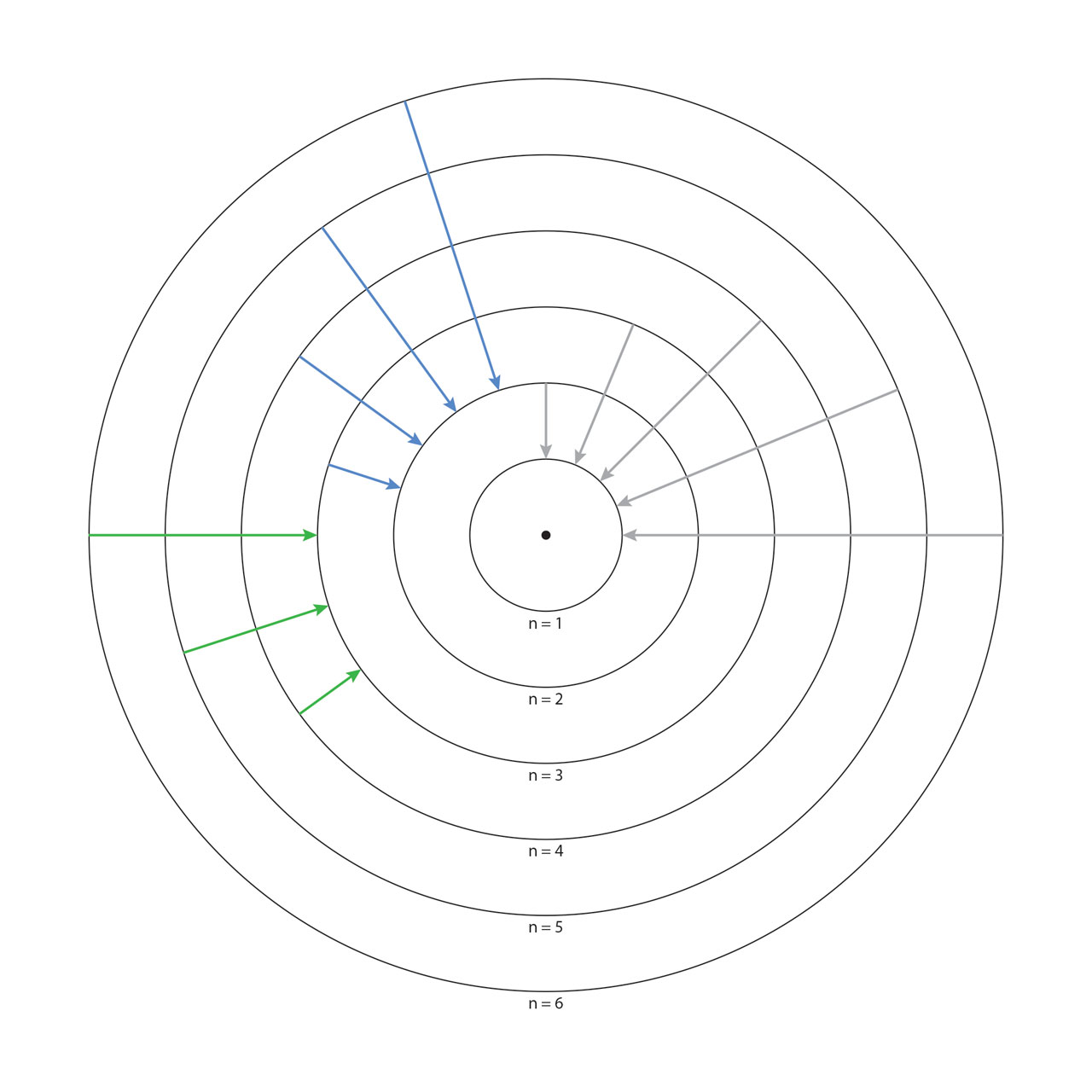
波尔量子原子模型。1913年,波尔提出了量子原子模型,这是现代科学史上最具革命性理论模型之一。波尔的量子原子类似一个微型的太阳系:一系列电子轨道环绕着中心带正电的原子核。每一个轨道都有特定的能量,低能轨道接近原子核,高能轨道远离原子核。电子必须处于某一个轨道当中,具有该轨道的能量。电子可以从一个轨道跃迁到另一个轨道,前提是电子必须吸收(从低能到高能轨道)或放出(从高能到低能轨道)具有特定能量的光子,而光子的能量就是两个轨道之间的能量差。波尔的量子轨道完美的解释了氢原子光谱(上图箭头显示了氢原子光谱中的莱曼系,巴耳末系和帕申系),也为随后出现的路易斯化学键理论奠定了的基础。1922年波尔因量子原子模型而获得诺贝尔物理学奖。【绘图依据:Bohr, N. Phil. Mag. 26, 1 (1913)】
第一行从左至右:2p轨道,3d轨道,3d轨道。
第二行:全部为4f轨道。